#01 がんゲノム医療とリキッドバイオプシー
連載:血液でがんを見つける、理解する 「リキッドバイオプシー」最前線
2026.02.07
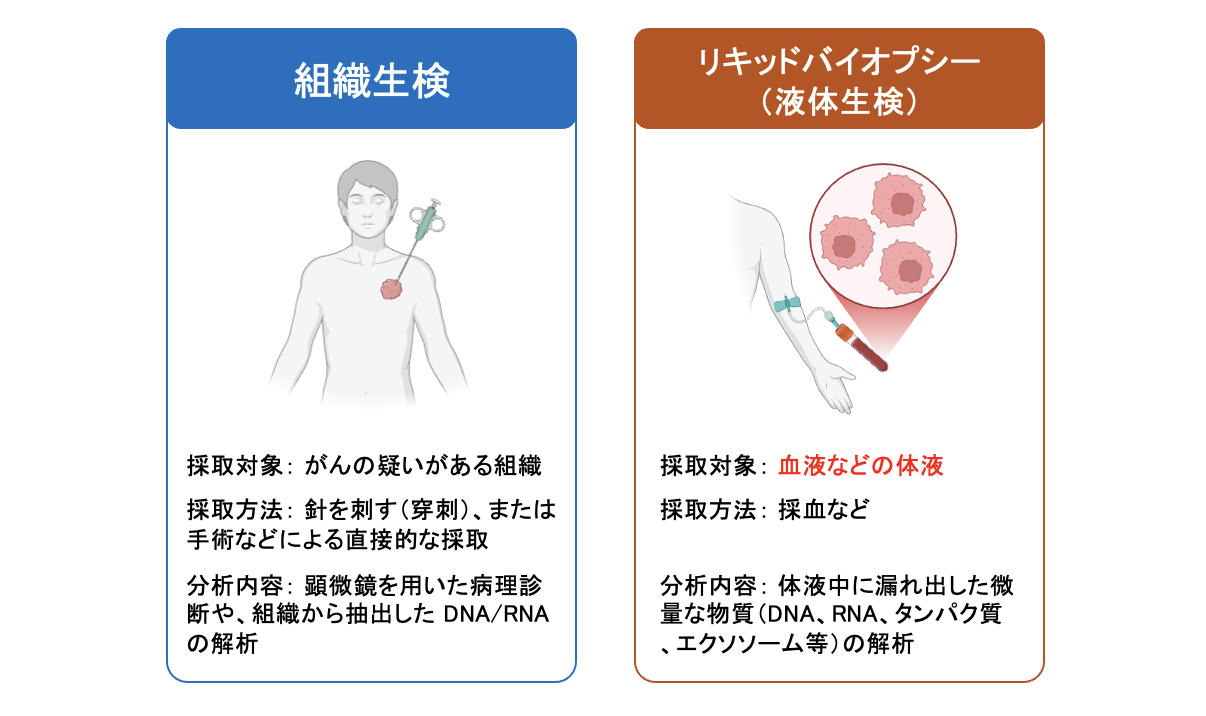
従来、がんの「確定診断」や「遺伝子解析」を行うには、身体に針を刺したり、手術で組織を採取したりする「組織生検」が必要不可欠でした。
もし、そのプロセスが採血だけで済むとしたら?
わずかな血液を採取するだけで、がんの遺伝子変異を特定し、最適な治療薬を見つけ出す技術――それが「リキッドバイオプシー(液体生検)」です。従来の組織生検に比べて身体への負担が極めて少ないだけでなく、再発予測や早期発見の可能性も秘めた、がん医療の新たな武器といえます。
本連載で取材するのは、オックスフォード大学の中村能章先生。世界の最前線でリキッドバイオプシー研究に取り組む第一人者です。
がん医療のパラダイムシフトをもたらすこの技術は、現在どこまで進化し、臨床現場をどう変えつつあるのでしょうか。1記事目となる本記事は、リキッドバイオプシーの特徴と臨床現場での役割についてです。
取材協力:中村能章先生(オックスフォード大学 腫瘍学部門)

■略歴
2009年3月 大阪大学医学部卒業
2009年4月〜2011年3月 天理よろづ相談所病院 初期研修医
2011年4月〜2014年3月 亀田総合病院腫瘍内科 後期研修医
2014年4月~2019年3月 国立がん研究センター東病院 消化管内科レジデント・がん専門修練医
2019年4月~2022年4月 国立がん研究センター東病院 トランスレーショナルリサーチ支援室医員/消化管内科医員
2022年5月〜2025年4月 国立がん研究センター東病院 国際研究推進室室長/トランスレーショナルリサーチ支援室医員/消化管内科医員
2025年5月〜現在 University of Oxford, Department of Oncology, Royal Society Wolfson Visiting Fellow、国立がん研究センター東病院 トランスレーショナルリサーチ支援室外来研究員
リキッドバイオプシーとは
リキッドバイオプシー(液体生検)とは、血液などの体液を用いてがんの情報を得る医療技術です。従来の組織生検では、針を刺したり手術を行ったりして、がん組織そのものを直接採取する必要がありました。一方、リキッドバイオプシーでは、血液中に流れ出たがん細胞や、がん細胞から放出された物質(DNA, RNA, タンパク質, エクソソームなど)を検出・解析します。がんの治療選択や再発予測、早期発見のために用いられています。
リキッドバイオプシーの種類
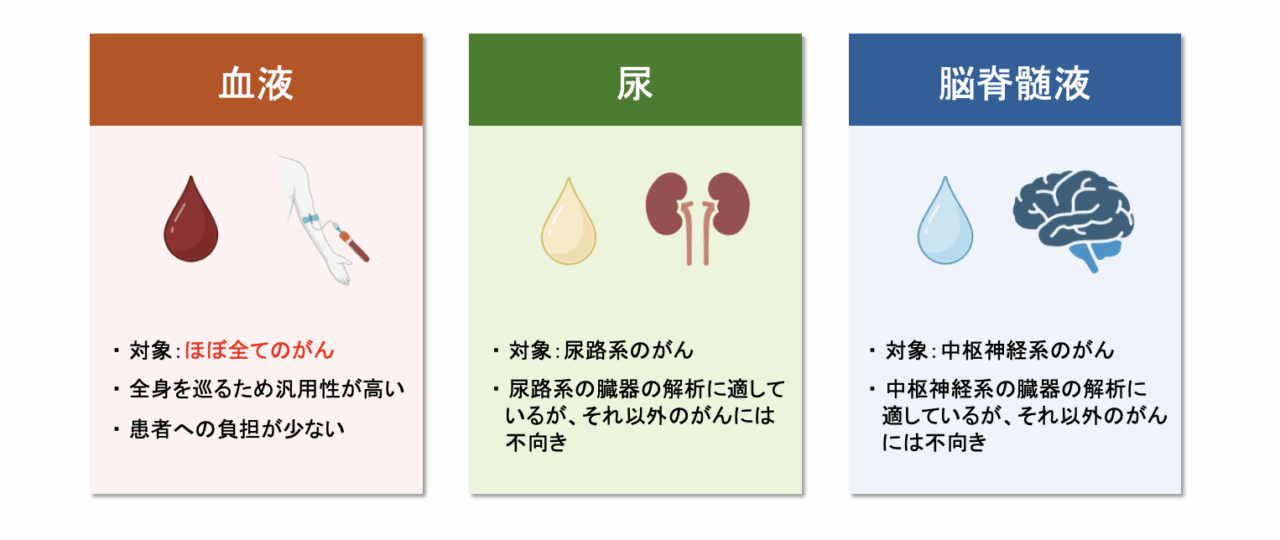
中村:がん医療においては組織生検によってがん細胞を採取し、解析することが一般的ですが、それを体液を用いて行うのがリキッドバイオプシーです。体液と言っても、血液や尿、脳脊髄液などの種類があって、その中でも血液がよく使われます。というのも、尿であれば尿路系のがん(腎臓がんや膀胱がんなど)、脳脊髄液であれば中枢神経系のがん(脳腫瘍や脊髄腫瘍など)の解析に適していますが、その他のがんには適していないことが多いです。一方で、血液は身体中を巡っているので、臓器を問わずほぼすべてのがん種に対応できるという利点があります。また、採血は患者さんへの負担が少なく、繰り返し検査することも容易です。そのため、現在のリキッドバイオプシー研究の多くは血液を対象としています。
リキッドバイオプシーの用途
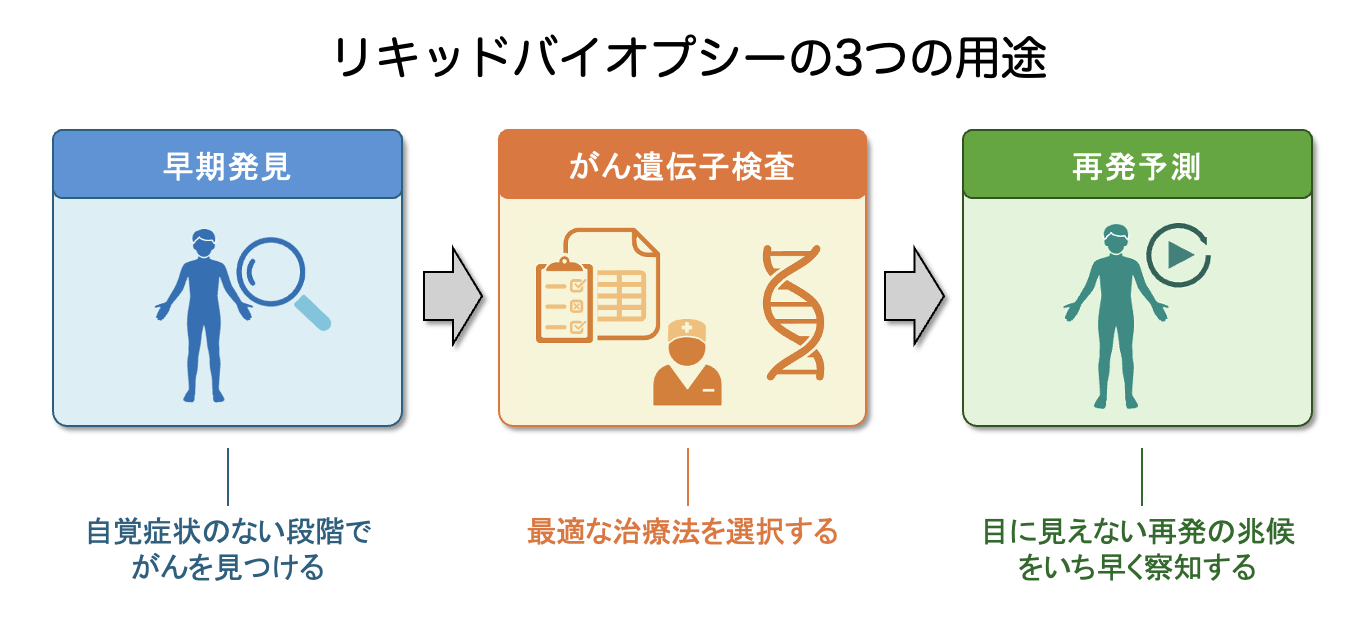
中村:主に3つの用途があります。一つ目は、主に進行がんの患者さんに対して行う「がん遺伝子検査」です。これは、検体からがんの遺伝子変異を特定することで、個々の症例に最適な治療方針を決定する判断材料として活用されます。検査には、手術や針を刺す検査でがんの組織を直接採ってくる方法(組織生検)が一般的ですが、今回のリキッドバイオプシーのように血液を用いる場合もあります。
中村:二つ目は、主に手術を行える患者さんに対して行う、手術後の「再発予測」です。手術で腫瘍を取り除いた約1ヶ月後に採血を行い、血液中に微量のがん由来の物質が漏れ出していないかを監視します。もし血液中にがんの痕跡が全く認められなければ、その患者さんは「すでに治癒している」可能性が高いと判断できます。逆に、血液中に反応が出た場合は、再発に対してより早期に、先手を打って治療を開始できる可能性があります。
中村:三つ目は「がんの早期発見」です。リキッドバイオプシーを用いた検査によって、自覚症状のない段階でがんを見つけ出します。特に近年は、特定のがん1種類だけを調べるのではなく、一度の採血で複数のがんを同時に検査する「MCED(Multi-Cancer Early Detection:多がん早期発見)」というアプローチが開発されています。
組織生検に比べて優位な点
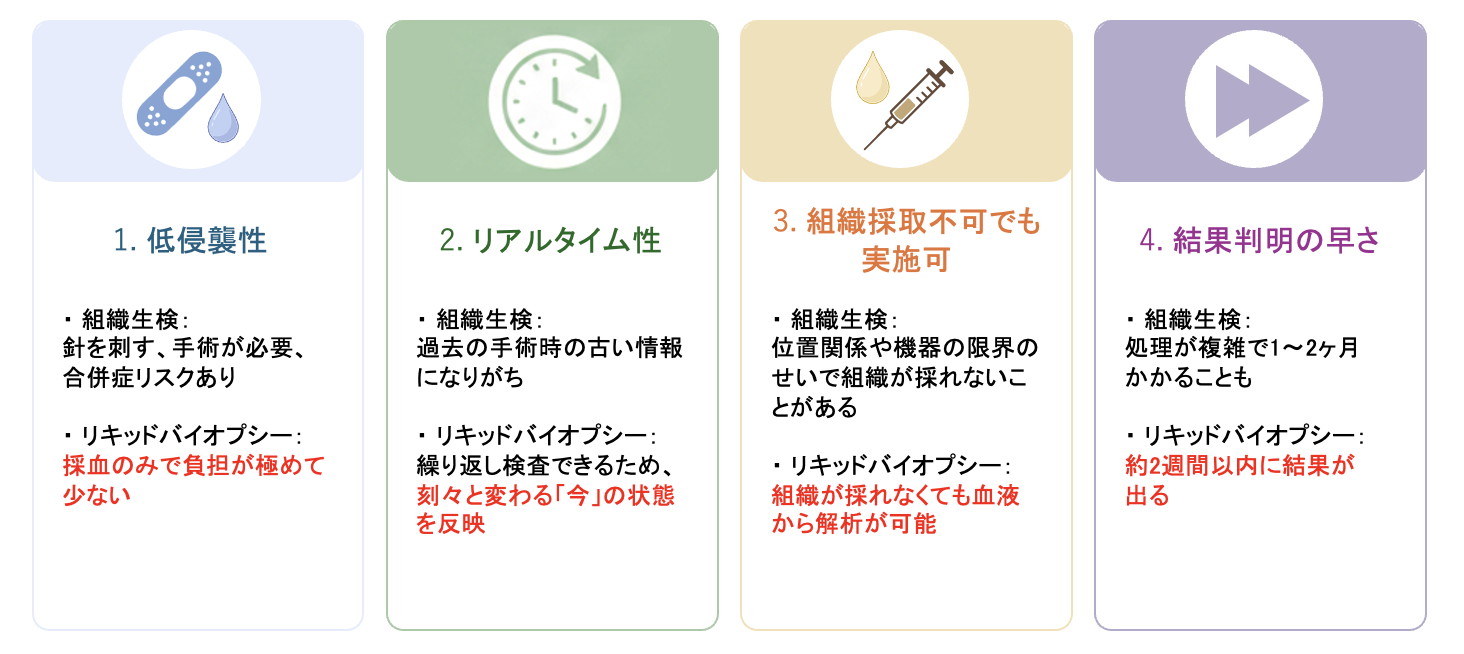
中村:リキッドバイオプシーは組織生検に比べて4つの理由で優れていると考えています。1つ目は「低侵襲性(体への負担の少なさ)」です。組織生検は、がんの組織を採るために体に針を刺すなど、非常に侵襲性が高く、場合によっては合併症のリスクも伴います。一方、リキッドバイオプシーの場合は血液を採取するだけなので、組織生検と違って患者さんの身体に負担をかけることがありません。
中村:2つ目は「リアルタイム性」です。がんの性質は、治療の過程で刻々と変化します。過去の手術で採った組織は「その時点でのがん」の情報しか持っておらず、現在の状態を反映していないことがよくあります。 何度も組織生検を行うのは大変ですが、血液なら繰り返し採取できるため、「今のがんの状態」をリアルタイムに捉えることができます。
中村:3つ目は「腫瘍組織が手に入らない場合にも利用可能」ということです。がん種によっては、医療機器の限界で、がん組織を採取することができないことがあります。そういった場合にも、血液を採取するだけで遺伝子検査を行える点で、リキッドバイオプシーは優れています。
中村:4つ目は「検査結果が出るまでの早さ」です。 組織生検の場合、採取した組織の処理などが複雑で、結果がわかるまでに1ヶ月、長いと2ヶ月近くかかってしまうことがあります。 進行がんは病状の変化が速いため、結果を待っている間に体調が悪化してしまい、本来受けられたはずの最適な治療を受けるチャンスを逃してしまうということが起こり得るのです。その点、リキッドバイオプシーは、検体処理が比較的シンプルなため、2週間以内には結果がわかります。診断までの時間を大幅に短縮できるため、患者さんの体力が十分にあるうちに、いち早く最適な治療をスタートさせることができるのです。
リキッドバイオプシーの課題
中村: 一番の課題は「感度(※1)の低さ(検出の難しさ)」です。がん遺伝子検査において、リキッドバイオプシーでは血液中に漏れ出した微量のがんのDNA(ctDNA : circulating tumor DNA)を探し出すのですが、これが非常に難しいのです。血液中のDNA全体のうち、がん由来のものが「1万個に1個」程度しか含まれていないことがあります。がん遺伝子検査で用いられる技術で正確に見つけるためには、少なくとも「100個〜1000個に1個」は含まれていないと厳しいとされてきました。つまり、従来の技術で捉えられる限界よりも、実際の量がはるかに少ないケースが多く、これが「感度が低い」と言われる理由です。
※1 感度…陽性の人が陽性と診断される確率。ここでは、特定の遺伝子変異を持つ人を、検査で正しく「変異あり(陽性)」と判定できる確率のことをいう。
中村:なお、がん再発予測に使われているリキッドバイオプシーでは、技術進歩により100万個に1個のDNAも検出できるようになってきています。それでも、がん遺伝子検査の領域ではさらなる感度向上が求められており、感度は依然として重要な課題となっています。
中村:また、感度はがんの種類によっても異なります。大腸がんなどは血中のctDNA量が多く比較的検出しやすいのですが、一方で血中濃度が極めて低く、感度が下がってしまうがん種も存在します。こうした「見つけにくいがん」に対しても精度を高めていくことが、今後の大きな課題です。

中村:さらに、検査の精度を評価する指標には「感度」と並んで「特異度(※2)」があります。リキッドバイオプシーは血中の遺伝子変異を捉えますが、中には加齢に伴う無害な変異もあり、それを「がん由来」と誤判定してしまうことがあります。この誤判定を減らし、いかに「特異度」を上げていくかも、実用化における重要なポイントだと考えています。
※2 特異度…陰性の人が陰性と診断される確率。ここでは、特定の遺伝子変異を持たない人を、検査で正しく「変異なし(陰性)」と判定できる確率のことをいう。
組織生検とリキッドバイオプシーの使い分け
中村:基本的には、組織検体が採取できるのであれば、組織を用いた検査が第一選択となります。 しかし、「組織を採取できない場所にがんがある」もしくは「手元にある組織が古すぎて今のがんの状態を反映していない」といった場合には、リキッドバイオプシーを選択することがあります。 組織の代用として使う側面もありますが、リキッドバイオプシーには「結果が早く出る」という特長がありますので、すぐに治療を始めたい進行がんの患者さんにとっては、非常に有力な選択肢となります。

国内のリキッドバイオプシー検査
中村: 現在、国内で行われている検査は、大きく分けて2つのタイプがあります。 1つは、特定の薬が効くかどうかを判定するために、1つや2つの遺伝子変異をピンポイントで調べる「PCR法(※3)などを用いた単一遺伝子検査」です。 もう1つは、数百もの遺伝子を一度に解析し、治療の可能性を網羅的に探索する「次世代シークエンサー(※4)を用いたがんゲノムプロファイリング検査」です。
※3 PCR法(Polymerase Chain Reaction:ポリメラーゼ連鎖反応)…特定の遺伝子配列を数百万倍に増幅させて検出する技術。感度が高く、特定のターゲットをピンポイントで素早く見つけるのに適している。
※4 次世代シークエンサー…膨大な数のDNA断片を同時に並行して読み取ることができる装置。従来の装置に比べ、飛躍的に高速かつ網羅的な解析が可能となり、数百種類の遺伝子変異を一度の検査で特定できるようになった。
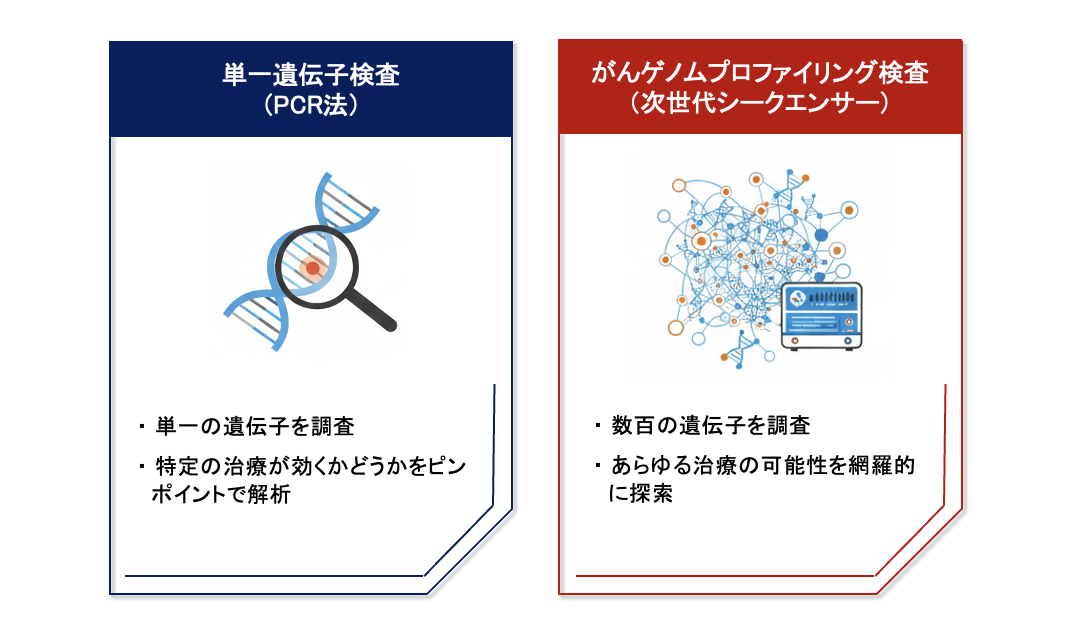
中村:「PCR法などを用いた単一遺伝子検査」に関しては、肺がんにおけるEGFR遺伝子の変異を調べる「コバス EGFR 変異検出キット」や、大腸がんにおけるRAS遺伝子の変異を調べる「OncoBEAM RAS CRC キット」などが日本で承認されています。
中村:「次世代シークエンサーを用いたがんゲノムプロファイリング検査」に関しては、「FoundationOne Liquid CDx がんゲノムプロファイル」や「Guardant360 CDx がん遺伝子パネル」といった検査が日本で承認されています。
中村:いずれのタイプの検査も、陽性となれば患者さんに適切な治療を行えるようになります。組織生検とリキッドバイオプシーをしっかりと使い分けることで、患者さんが得られる恩恵を最大化できることを目指しています。
(#02へ続く)






































![[がん治療の現状と課題]放射線治療の課題、秋元先生の取り組み #03](https://doctor-journal.com/wp-content/uploads/2024/02/06e0d7d2282c5b5f17ff718a92ca8b70-80x80.png)
![[がん治療の現状と課題]患者の懸念、医療制度の課題 #02](https://doctor-journal.com/wp-content/uploads/2024/01/f921745e9e011d0f14238fc3803310b9-80x80.png)


