がんの遺伝子検査、種類と従来の問題点 細胞診検体を使うべき理由とは
連載:【細胞診検体を用いたがん遺伝子検査MINtS】全ての患者さんを救うために
2024.05.18
肺がんの遺伝子検査の第一人者である萩原先生が語る本連載、1記事目となる本記事は、肺がん治療における遺伝子検査の位置付けやその種類、問題点についてです。
がん治療における分子標的薬や遺伝子検査の位置付け
がん治療は大きく「手術療法」「化学療法」「放射線療法」「がん免疫療法」に分類されます。この化学療法のうち、がん特有の分子に作用する薬を「分子標的薬」といいます(図1)。
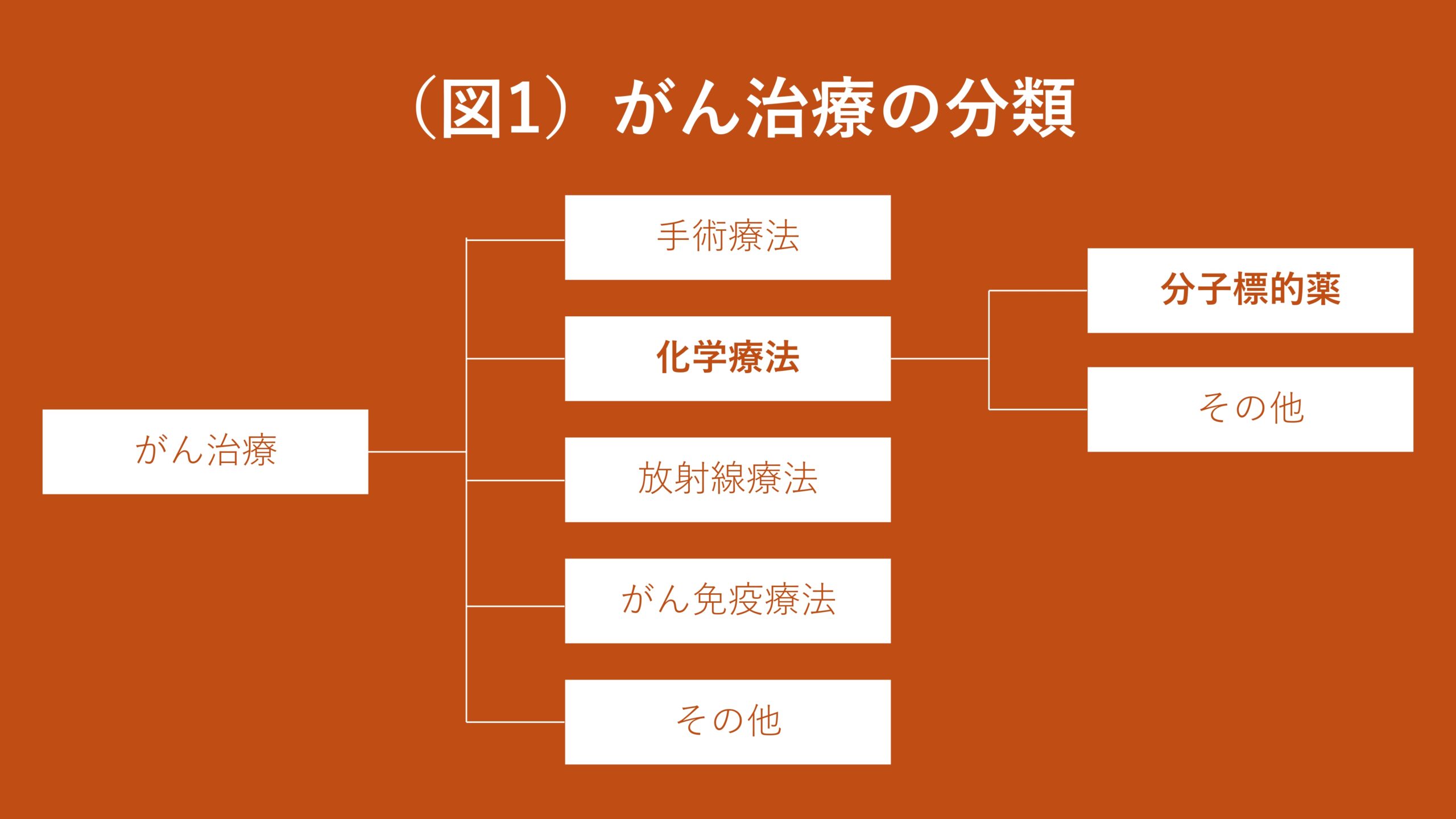
分子標的薬でない化学療法とは、薬によってあらゆる細胞の増殖を抑える治療です。あらゆる人に効きますが、正常な細胞の増殖をも抑えるので、吐き気や脱毛などの強い副作用をもたらすことがあります。
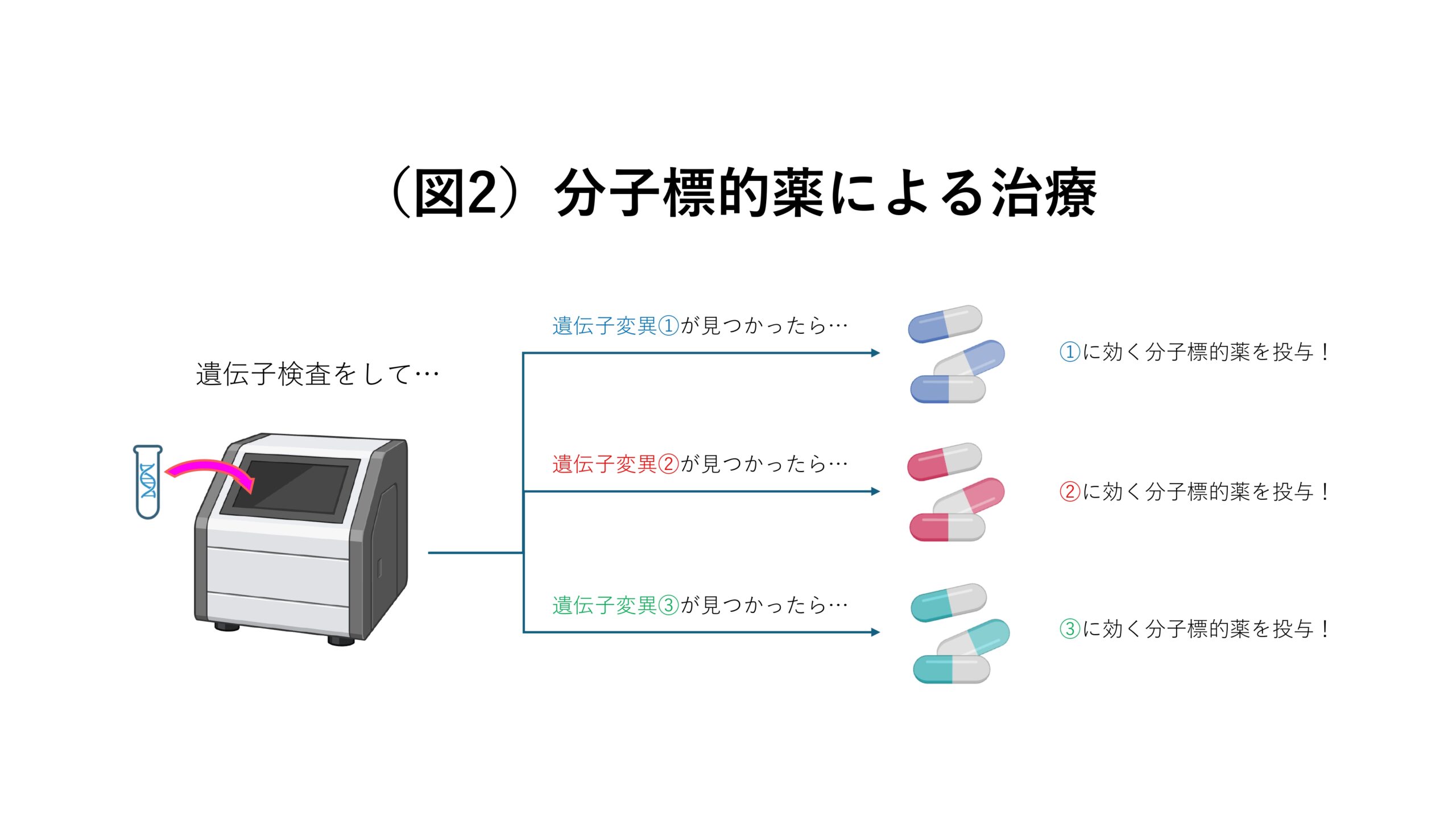
分子標的薬とは、がん特有の分子にだけ作用する薬のことです。がん特有の分子には様々あり、患者さんによって異なります。なぜなら、患者さんごとにがんの発症原因となっている遺伝子変異が異なるからです。ですので、あらかじめ遺伝子検査を行なって原因の遺伝子変異を調べてから、それに効く分子標的薬を投与するというのが現在の通例です(図2)。また、特定の分子にしか作用しない分、分子標的薬はその他の化学療法に比べて副作用が低く、治療効果が出やすいと知られています。特にALKという遺伝子の変異に効く分子標的薬は、5年生存率が6割を超えるという劇的な効き方をしています。
遺伝子検査をせずに分子標的薬を使用する危険性
肺がんに用いる分子標的薬としては、その原因となるEGFR変異に特異的に作用するイレッサ(一般名:ゲフィチニブ)が最も古い例です。これを使えば、手術で肺がんを取り除けないような進行肺がんの患者さんでも、4割ほどは5年以上生きられるというのがわかったのです。
ただこの頃に、これほど有効なのであれば、遺伝子検査をしなくても全ての患者さんに投与すればいいのではという考えが出てきました。検査をするのは大変なので、検査の段階を飛ばしてしまおうということです。そして実際に、遺伝子検査を実施しないままたくさんのイレッサが投与されました。しかし副作用によって重篤な肺炎を起こして亡くなる方が全国で800人ほど確認されたのです。
その教訓として、どんな遺伝子変異が原因かということをちゃんと確認してから分子標的薬を投与しないと酷い目に遭うということがわかったのです。
遺伝子検査は検体の種類によって2つに分類される
患者さんの体から採取する小さな組織片を「検体」といい、これをもとに患者さんの遺伝子を読み取ります。検体の取り方によって、遺伝子検査は2つに分類できます。組織診検体を用いる検査と細胞診検体を用いる検査です。
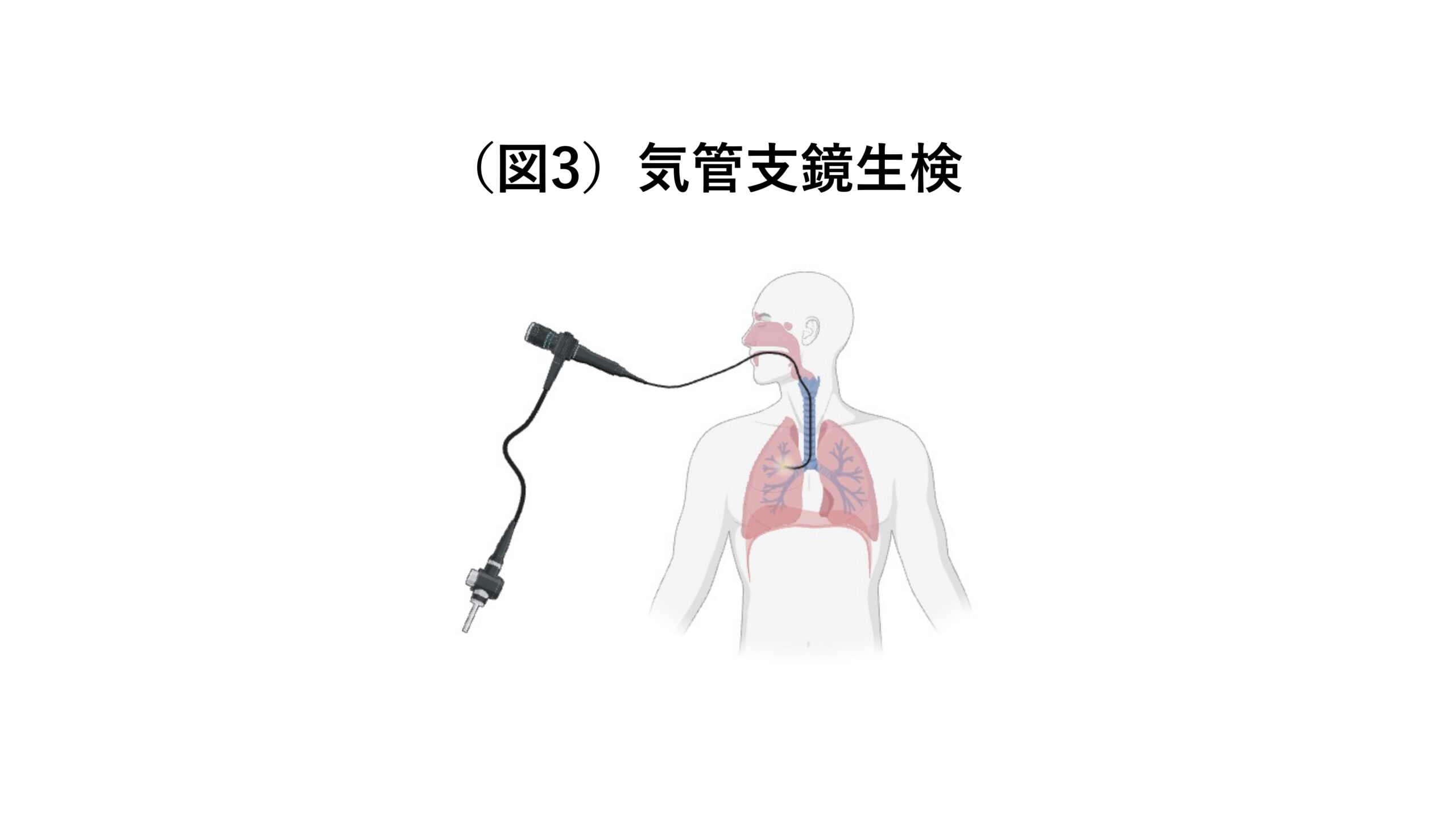
組織診検体とは、組織の一部を切り取ったものです。例えば肺がんの場合、日本では気管支鏡を使って検体を採取するのが主流です(図3)。気管支鏡と呼ばれる細い管を口または鼻から入れ、気管、気管支を通り奥の方まで進みます。がん細胞と疑わしき場所までたどり着いたら、気管支鏡の先についている鉗子で組織をつまんで取ってきます。取ってきた組織は、ホルマリンで固定し、パラフィンに埋め込み、薄くスライスして、遺伝子変異の検査に出します。このホルマリン固定の際にDNAが化学修飾を受けることで検体の質が落ちてしまったり、パラフィン包埋処理の際にタンパク質に結合したDNAが引きちぎられたりしてしまうため、このやり方では遺伝子検査の精度が低いというデメリットがあります。一方病理の先生にとっては、組織が残っている方が診断しやすいというメリットがあります。
一方で、細胞診検体とは、取ってきた組織を細胞ごとにまでばらばらにしたものです。気管支鏡を使って採取する方法が一般的です。細胞診検体の場合には、気管支鏡の先端にブラシをつけ、表面を擦ることにより、目的の細胞を取ってきます。また細胞診検体の場合は、固定の際にDNAが損傷を受けることが少なく、遺伝子検査には向いていると言えます。
正確な検査をするためには、組織診検体では検体中の約30%ががん細胞でないといけないのに対し、細胞診検体では検体中の約1-3%ががん細胞であればよいというデータも出ています。
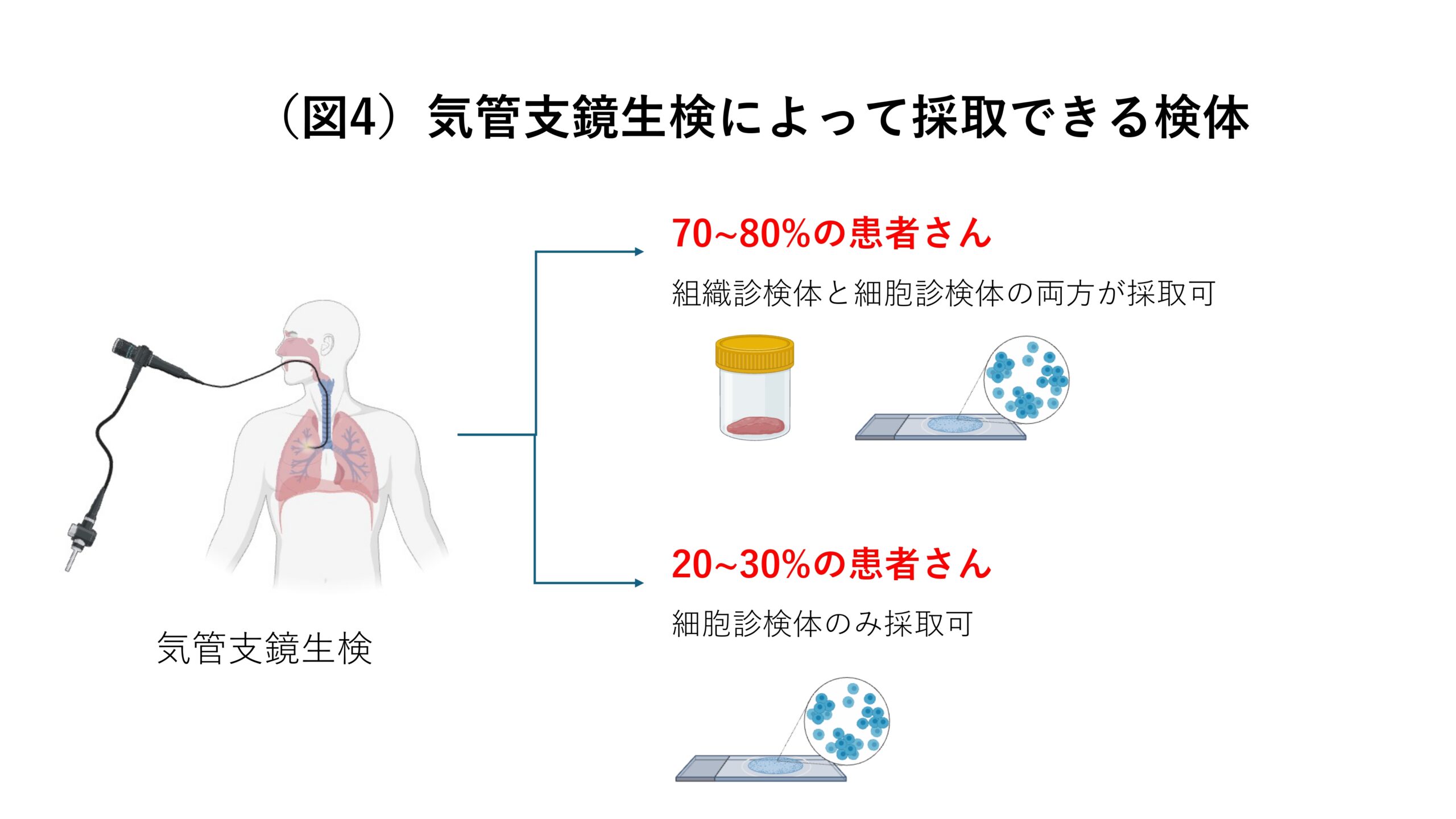
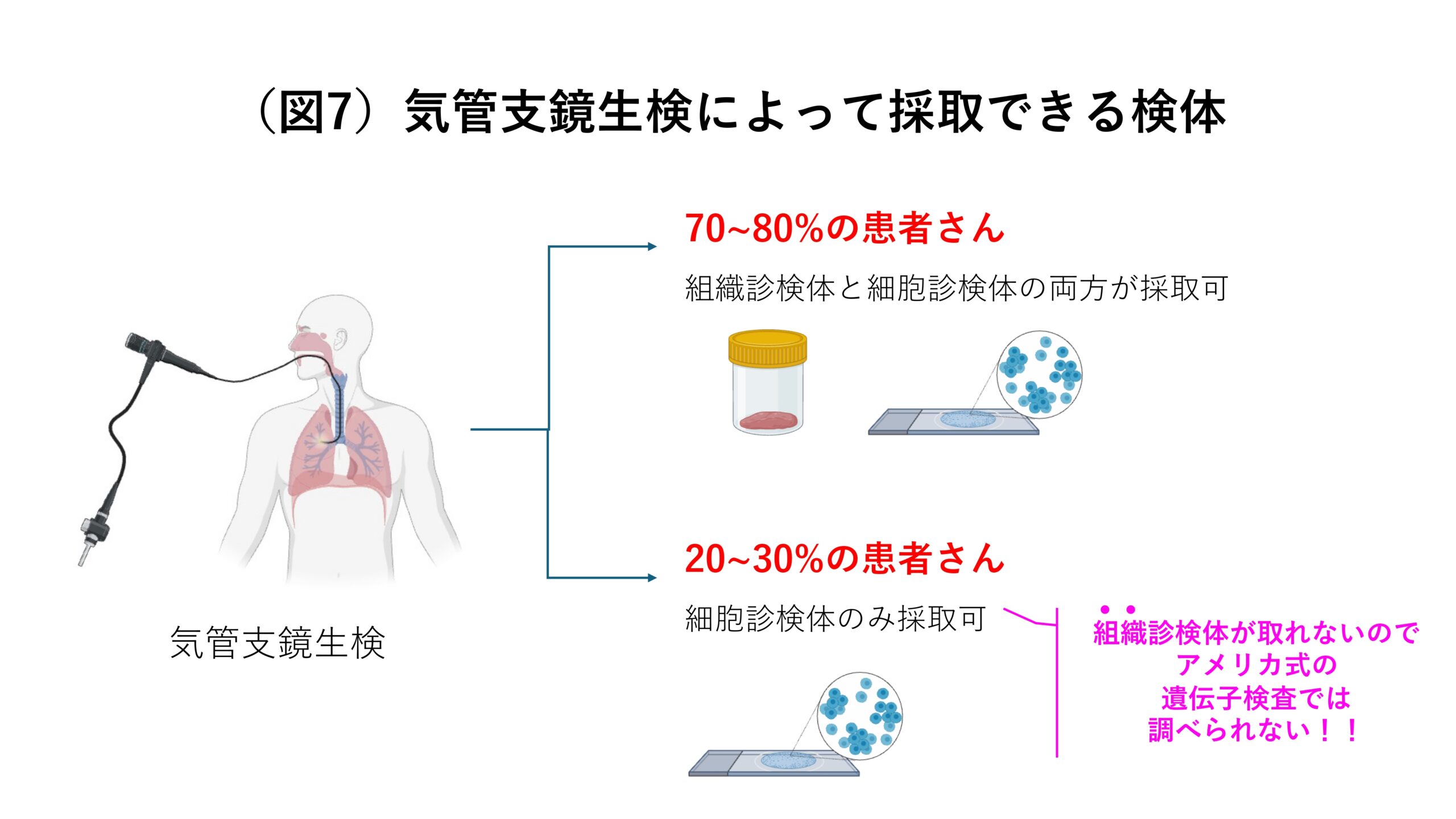
日本では気管支鏡をつかって検体を採取するのが主流です。気管支鏡を用いる場合、70~80%の患者さんからは組織診検体と細胞診検体の両方が採取できるのですが、20~30%の患者さんからは細胞診検体しか取れません(図4)。したがって、この20~30%の患者さんに対しても遺伝子検査を行えるようにするためには細胞診検体を用いた遺伝子検査を普及させるのが重要であると言えます。
細胞診検体を用いた遺伝子検査の開発
細胞診検体しか採取できない患者さんに対しても検査を行えるように、細胞診検体を用いた遺伝子検査を開発しようと試みました。そこで考えるべきことが2つありました。
- どのようにしたら細胞診検体で検査を行えるのか
- 検査の感度をどの程度にすれば良いのか
です。
まず「1. どのようにしたら細胞診検体で検査を行えるのか」について。
がんの遺伝子検査において少し重要なのが、がんをがんと診断できるのは病理の先生の目しかないという点です。ですので、病理の先生ががんと診断した細胞を遺伝子検査に使う必要があります。
そこで、「二分法」を開発しました。二分法とは、患者さんから採取した検体のうち、半分はがんの診断に用い、がんと診断された場合には残りの半分を用いて遺伝子検査を行うというものです。こうすることで、病理の先生によってがんと診断された細胞だけを遺伝子検査にかけることができるようになるのです(図5)。
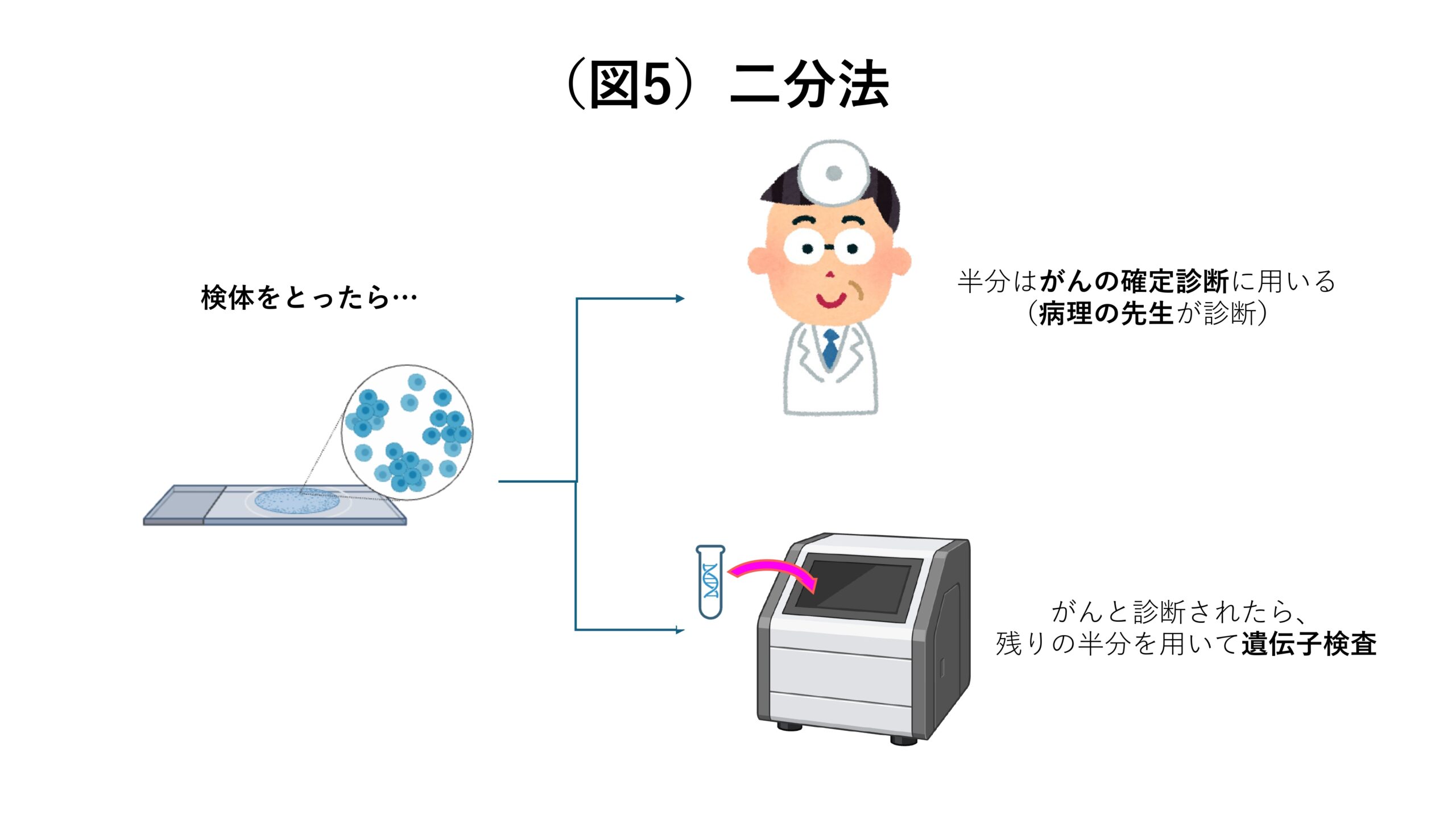
次に「2. 検査の感度をどの程度にすれば良いのか」について。
先ほど言った通り、病理の先生ががんの診断を下します。しかし、同時に行う検査も、病理の先生と同程度以上の感度でがんを検出できなければ意味がありません。そこで、病理の先生ががんと診断した検体を、画像解析によって調べました。そうすると、検体中に1%ほどがん細胞があれば、病理の先生はがんと診断しているとわかりました。それに合わせて検査の感度も高めました。
そうして、2005年にPNA-LNA-PCR clamp法という方法を用いた遺伝子検査を開発しました。この検査によって、細胞診検体を用いて肺がんの原因の遺伝子変異の1つであるEGFR変異を検出できるようになりました。
細胞診検体を用いた遺伝子検査から見えてきた今後解決すべき課題
この検査が多く用いられたことで進行肺がんの全例検査を実現することができました。この点でとてもうまくいったと思います。
しかし、今後解決すべき課題も2つ見つかりました。
- 提出される細胞診検体の質
- アメリカの技術の転用
の2つです。
まず「1. 提出される細胞診検体の質」について。
検査を開始した頃は、どの施設も良い検体を提出してくれていたのですが、時間が経つにつれいい加減な検体を提出する施設が増えてきたのです。施設によっては、ほぼ水と言ってもよいほど質の悪い検体が提出されることや、検体を入れている容器の蓋が緩んでいて液体が少し溢れていたりすることがありました。そのような質の悪い検体だと、正確な結果を出すことができません。実際にEGFR変異を持っていた患者さんの中には、検体の質が悪かったがゆえにEGFR変異の結果が出ず、治療の機会を失ってしまった方もたくさんいました。
次に「2. アメリカの技術の転用」について。
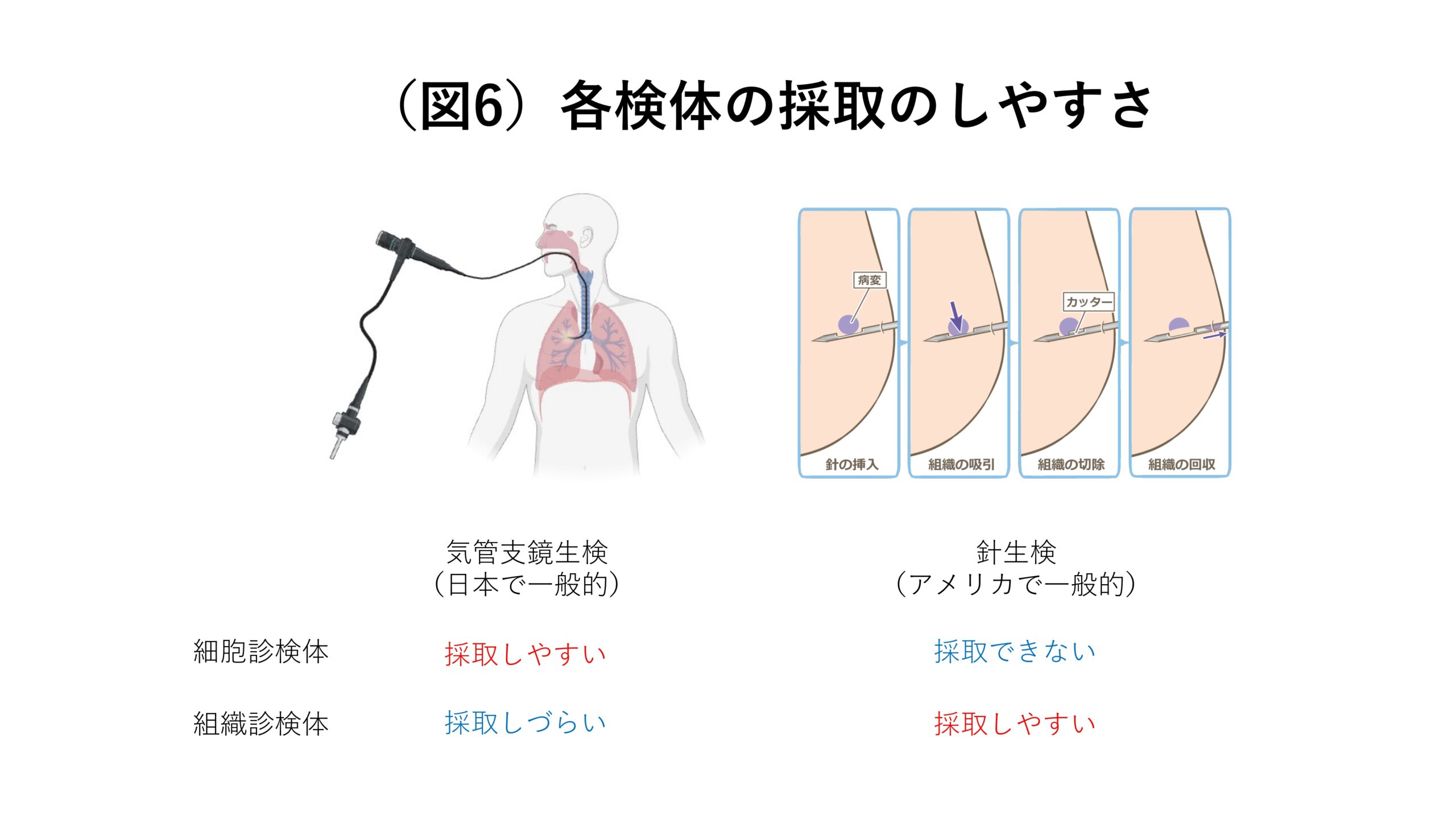
歴史を踏まえて説明しますね。昔からアメリカでは体の外から針を刺して皮膚越しにがんの組織を採取する「針生検」が一般的です。針生検によって採取できるのは「組織診検体」です(図6)。したがって分子標的薬が登場してその適切な薬剤選択や投与量を決めるために検査をするべきという考えが全世界で広まった頃、アメリカでは組織診検体に対応した診断方法が主流となり、それが日本にも転用されるようになりました。そうやって、日本でも組織診検体を用いた遺伝子検査が一般的になっていったわけです。
ここで問題なのは、日本では針生検ではなく気管支鏡生検が一般的であり、組織診検体を採れない患者さんが20〜30%ほどいらっしゃることです。そうした患者さんに対応する診断方法は無く、救えないという現状が続いてしまいました(図7)。
――そこで萩原先生が開発に取り組まれたのが、細胞診検体を用いた遺伝子検査MINtSだったのですね。
その通りです。
―次記事に続くー
<自治医科大学 呼吸器内科学部門>
ホームページ:https://www.jichi.ac.jp/usr/kokyu/index.html
TEL:0285-58-7350









































![[がん治療の現状と課題]放射線治療の課題、秋元先生の取り組み #03](https://doctor-journal.com/wp-content/uploads/2024/02/06e0d7d2282c5b5f17ff718a92ca8b70-80x80.png)
![[がん治療の現状と課題]患者の懸念、医療制度の課題 #02](https://doctor-journal.com/wp-content/uploads/2024/01/f921745e9e011d0f14238fc3803310b9-80x80.png)

