新たながん遺伝子検査MINtS 見えてきた優位性と今後の課題
連載:【細胞診検体を用いたがん遺伝子検査MINtS】全ての患者さんを救うために
2024.05.25
肺がんの遺伝子検査の第一人者である萩原先生が語る本連載、2記事目となる本記事は、細胞診検体を用いた遺伝子検査MINtSの優位性や重要性、課題についてです。
【1記事目のまとめ】
進行肺がんの患者さんへよく行われる化学療法、その中でも特に効果を発揮するのが分子標的薬です。分子標的薬は、がん特有の分子にのみ作用することで副作用が抑えられ、高い安全性を発揮できるわけですが、そのがん特有の分子を見つけるためには遺伝子検査を行わなければなりません。そして、遺伝子検査には、細胞診検体を用いた検査と組織診検体を用いた検査の2種類があります。それぞれにメリットとデメリットがありますが、重要なのは気管支鏡を用いた生検が多い日本では、それによって採取しやすい細胞診検体を用いた遺伝子検査が必要な患者さんが多いのにも関わらず、遺伝子変異検査は組織診検体で行わなければならない制度になってしまった、というやや矛盾した現状があるという点です。これでは、組織診検体を採取できない患者さんに対して検査を行うことができないという問題がありました。
細胞診検体を用いた遺伝子検査MINtSの開発
この問題を解決すべく、2012年から細胞診検体を用いた遺伝子検査MINtSの開発に取り掛かりました。MINtSは、患者さんから採取した細胞診検体を次世代シークエンサー(*1)によって解析し、がんの原因の遺伝子変異を見つけるというものです。今は、9つの遺伝子変異を検査対象にしています。これにより、細胞診検体からそれぞれの患者さん特有の異常な分子を見つけ出し、それに効く分子標的薬を投与できるわけです。

*1 次世代シークエンサー:遺伝子配列を網羅的に調べる機械。異常な遺伝子を調べることができる。
MINtS開発における目標
MINtSを開発するにおいて、2つの目標がありました。
- 検査の精度が良いことを確かめる
- 「良い検体」を定義し、それを採取するための手技を確立する
この2つです。
まず「1. 検査の精度が良いことを確かめる」について。
やはり、一般的に用いられているコンパニオン診断(組織診検体を用いた遺伝子検査)と同程度の精度であることを保証しなければ検査として使えませんので、それを確かめる必要がありました。
実際に我々がおこなった臨床試験を通して、この検査が高精度であることが分かってきました。様々な遺伝子変異の検体について、既存のコンパニオン診断とMINtSを行い、一致率を調べたのです。そうすると、ほとんどの検体で結果が一致しました。特に肺がんの遺伝子変異として最も多いEGFR遺伝子変異の検体に関しては、結果が一致しなかった検体についても、別の既存のコンパニオン診断を行いました。そうすると、その全てでコンパニオン診断とMINtSの結果が一致しました。
よってEGFR遺伝子変異に関しては、MINtSはかなり高精度の検査結果を出せるということがわかり、他の遺伝子変異に関しても精度が高いということが分かりました。
したがって、1つ目の目標は達成されたと言えると思います。
次に「2.「良い検体」を定義し、それを採取するための手技を確立する」について。
2005年に開発した遺伝子検査の使用の際も問題になっていたように(1記事目を参照)、細胞診検体を用いた遺伝子検査では検体の質が検査の精度に関わってくるのです。当時は、ほぼ水と言ってもよいほど質の悪い検体が提出されることや、検体を入れている容器の蓋が緩んでいて液体が少し溢れていたりすることがありました。つまり、ヒューマンファクターがかなり多い検査なのです。
そこで、このままじゃいかんと思ったんですね。
なぜなら「良い検体」を採取できていれば、ちゃんと陽性と診断され適切な分子標的薬が投与できていたであろう患者さんが、採取された検体の質が悪いゆえに正確な診断がなされずに治療の機会を逃してしまっているからです。遺伝子検査で陰性となれば別の検査を行うことで原因の遺伝子変異を探すわけですが、何度も検査を行なっても原因の遺伝子変異がわからず、調べ直してみると最初に行った検査が間違っていたなんてこともたくさんありました。
MINtS開発の際は、「良い検体」をしっかりと定義し、良い検体を取るための手技を教え込む、ということをしなければならないと考えました。
良い検体の定義と手技の確立
検体中に含まれるDNA量が100 ng以上、RNA量が50 ng以上のものを「良い検体(Optimal specimen)」としました。実際に、良い検体(Optimal specimen)とそうでない検体(Sub-optimal specimen)とで検査結果の比較をしたところ、偽陰性率にかなりの差が出ました。偽陰性率とは、陽性であるにも関わらず陰性であると判断してしまう確率のことです。
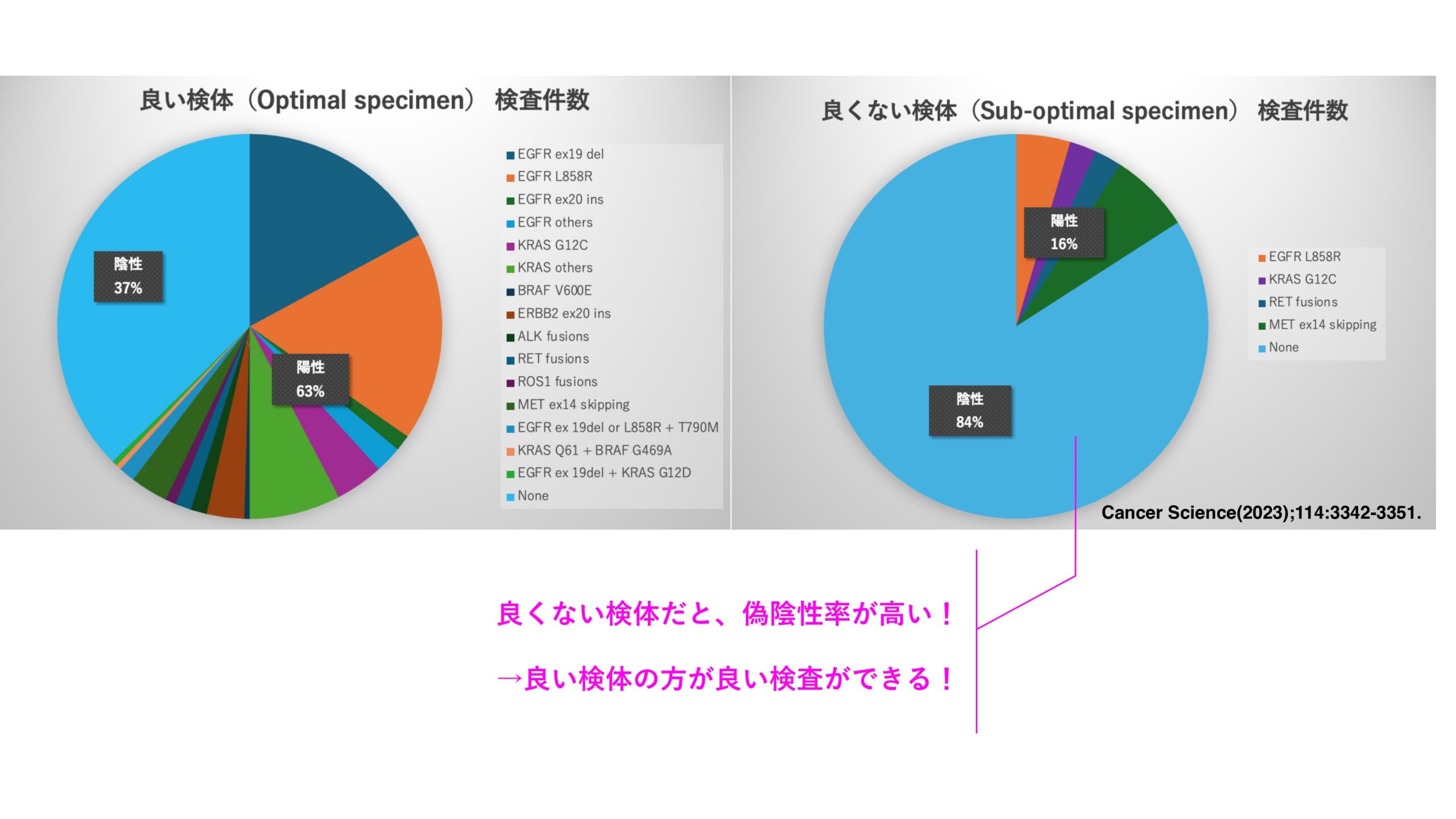
良くない検体では、偽陰性率がとても高くなったのです。偽陰性率が高いということは、本当は分子標的薬で救える患者さんに分子標的薬を使う判断を下せないということです。よって良い検体を用いる方が良い検査ができると言えます。
そして、良い検体を取るための手技も設定しました。自治医科大学で試験を108例行ったところ、その全てで良い検体を採取することができました。
良い検体を増やすための取り組み
このように良い検体を採取するための手技を確立し各医療施設に発信したにも関わらず、良くない検体を提出する施設はまだまだあります。検体採取に協力してくれた施設のうちの約半分は、提出した検体に含まれる良い検体の割合が8割に満たなかったのです。こうした施設にはこちらからもフィードバックを行い、検査の質を向上させる取り組みを進めています。
MINtSの優位性
MINtSの優位性は安くて高感度である点です。これは、検査対象の遺伝子変異の種類を最低限にすることによって実現しました。
対応する分子標的薬が存在する遺伝子変異のみを調べるようにしたのです。現在日本では9つの遺伝子変異に対して分子標的薬が存在するのですが、その9つの遺伝子変異の有無のみを調べているのです。
例えば、がん遺伝子パネル検査ではもっと多くの遺伝子変異を対象に検査をしているのですが、対応する分子標的薬が存在しない遺伝子変異を見つけてもそれに対して分子標的薬を用いることができません。もちろん臨床研究に活かすことはできると思いますが、分子標的薬の治療には直結しません。MINtSではそういった部分をなくし、できるだけ患者さんにメリットがあるような検査にしたのです。
今後、ある遺伝子変異に対応する分子標的薬が作られることになれば、その遺伝子変異も検査の対象に含めていきたいと考えています。
―次記事に続くー
<自治医科大学 呼吸器内科学部門>
ホームページ:https://www.jichi.ac.jp/usr/kokyu/index.html
TEL:0285-58-7350




































森口敦 ドクタージャーナル東大生チーム・コーチ兼メンター