自家がんワクチンのメカニズムを知れば、自分のがん組織を使う意義がわかる
連載:【徹底取材】セルメディシン社が提供する自家がんワクチンとは?
2022.05.21
がん免疫療法とは
がんに対する治療法やその考え方は年々アップデートされ、絶えず進歩を続けています。
最近では外科的治療、放射線治療、抗がん剤に次ぐ第4の治療法として、がん免疫療法が注目されています。免疫の働きを抑えるブレーキ役となるタンパク質を発見し、がんに対して免疫が働くようにする新たな治療薬の開発に貢献したとして、2018年に本庶佑氏がノーベル医学・生理学賞を受賞しました。その治療薬である「オプジーボ」やCAR-T細胞療法の「キムリア」はがん免疫療法の代表例と言え、保険診療が適用されています。しかし、このように保険適用されているがん免疫療法は決して多くはありません。
一方、科学的に有効性が示されていても、大規模な治験が実施されていないために自由診療として展開されているがん免疫療法があります。
科学的に有効である治療法なら自由診療であっても偏見なく知りたいという読者が増えてきました。そこでドクタージャーナルでは、自家がんワクチンというがん免疫療法を提供するセルメディシン(株)の代表取締役社長大野忠夫さん、広報担当の石原健さんに取材しました。

自家がんワクチンとは
自家がんワクチンとそのメカニズム
——自家がんワクチンとはどのようなワクチンですか?
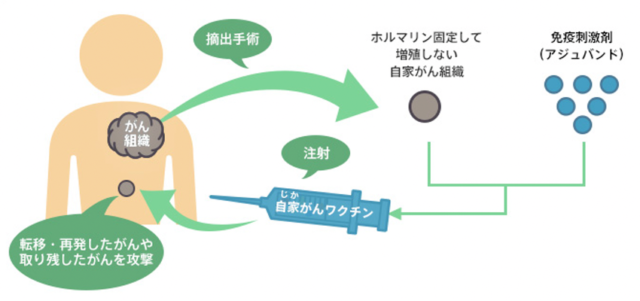
大野さん(以下、敬称略):自家がんワクチンとは、患者さんのがん組織を利用して作製される、その患者様専用のオーダーメイドワクチンです。摘出手術で得られホルマリン固定された自家がん組織と免疫刺激剤(アジュバンド)から自家がんワクチンを作製します。そのワクチンを注射することで、免疫力を強化し、転移・再発したがん、取り残したがんを免疫系に攻撃させます。
——生きたがん組織を打ち込むことにはなりませんか?また、ホルマリンは人体に有毒ではありませんか?
大野:ホルマリン固定によって全ての細胞が死ぬため、生きたがん細胞を体に取り込ませることにはなりません。また、ホルマリン自体は確かに人体に有毒ですが、安全性に全く問題のないレベルまで十分に洗浄除去されます。
——自家がんワクチンはどのようなメカニズムで免疫系を強化するのでしょうか?
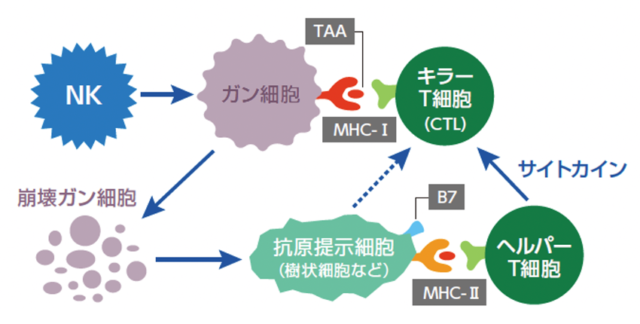
大野:自家がんワクチンを接種すると、死滅したがん組織が樹状細胞などの抗原を提示する細胞に取り込まれ、その中で消化されます。消化されて出てきたがん抗原がヘルパーT細胞に提示され、活性化されたヘルパーT細胞はサイトカインの放出を通してTリンパ球を活性化・増殖させます。これがキラーT細胞として成熟し、このキラーT細胞が生きているがん細胞の表面に発現しているがん抗原を目印としてがん細胞を殺します。
——それはまさに、昨今の新型コロナウイルスでも話題になった「ワクチン」そのものですね。
大野:はい。ただし、普通のワクチンと異なるのは自分のがん組織を使うところです。新型コロナウイルスワクチンは皆同じものが投与されますが、自家がんワクチンは患者さんごとにその中身が違います。
自分のがん組織を使う意義
——自分のがん組織を使うとどのような利点があるのでしょうか。
大野:通常、がん抗原は樹状細胞のような抗原提示細胞に取り込まれた後、ペプチド(アミノ酸が複数結合したもの)に分解され、このペプチドを目印としてリンパ球にがん細胞の特徴を知らせます。
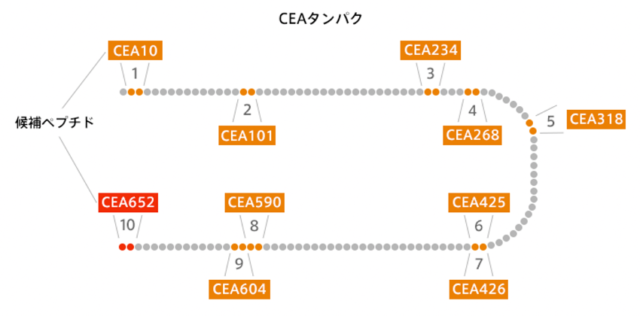
大野:図1-3はがん細胞のマーカーとなるタンパク質CEAの配列を模式的に表したものです。がん細胞の目印として使いやすいところ(赤い部分)、そうでないところ(オレンジの部分)がありますが、赤い部分以外のペプチドでも抗腫瘍活性があることが示されています。
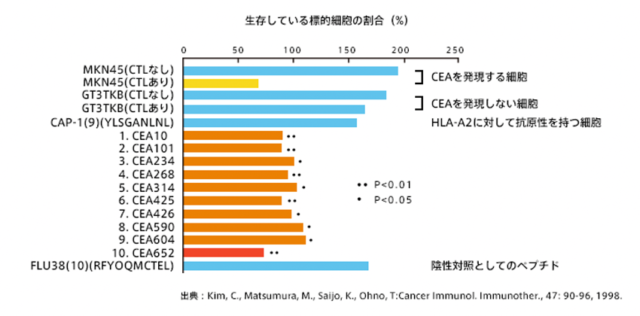
大野:この実験結果は、ホルマリン固定されたCEAタンパクから、それに含まれるがん抗原ペプチドに由来する多種類のCTLクローンが誘導されたことを示唆します。これほど多くのがん抗原ペプチドが発生するのならば、もしその他にもがん抗原タンパクががん細胞に含まれていれば、それらから発生するがん抗原ペプチドは膨大な種類になります。
このまだ明らかになっていないがん抗原タンパクをネオアンチゲンと言います。ネオアンチゲンは遺伝子の突然変異によって生じるため、その特徴は患者さん一人ひとりによって異なります。よって、ネオアンチゲンを合成するためには生きた組織の遺伝子解析とネオアンチゲンペプチドの候補推定が必要となりますが、それには膨大な作業が必要となります。
既知のがん抗原ペプチド、ネオアンチゲン、さらにそこに入り得る遺伝子変異を考慮すると、人工的に合成したわずかな種類のがん抗原ペプチドで全体のがん抗原を代替させようとするのは難しいということになります。
自分のがん組織であれば、その膨大な種類を網羅することができるのです。
——まさに自分にとって最適なオーダーメイドなワクチンですね。
お問い合わせ
次回の記事では自家がんワクチンを臨床で用いた事例についてご紹介します。
併せてメリット・デメリットについてもお伝えできればと考えています。
セルメディシン株式会社:https://cell-medicine.com/