CDC6とは?RNAiとは?がん遺伝子治療のメカニズムを知る。
連載:【尊厳あるがん治療】北青山Dクリニックが展開するCDC6 RNAi療法の可能性に迫る。
2023.09.13
今回取材を引き受けてくださったのは、北青山Dクリニックの阿保義久院長。
がん遺伝子治療の一つであるCDC6 RNAi療法の、国内における草分け的存在であり、これまで2,000回以上の治療を施されてきました。
阿保さんは本療法を、人としての"尊厳を保つ"治療と呼ばれています。
一体、どのような治療法なのか、どのようにして"尊厳を保つ"のか、お聞きしました。
■略歴■
東京大学医学部医学科 卒業(1993年)
東京大学医学部附属病院 第一外科(1993年)
虎ノ門病院 麻酔科(1993年)
東京都教職員互助会三楽病院 外科(1994年)
東京大学医学部附属病院 血管外科・腫瘍外科(1997年)
北青山Dクリニック 院長(2000年〜現在)
医療法人 DAP 理事長(2004年〜現在)
東京大学医学部 腫瘍外科・血管外科 非常勤講師(2010年〜2020年)

CDC6 RNAi療法とは
——CDC6 RNAi療法とは、どのような治療法か教えていただけますか?
阿保:がんは、正常細胞が突然変異してできるもので、その最大の特徴は、正常細胞にはみられない、無限に増殖するという性質を持つことです。本療法では、外科療法や放射線療法のように「がん細胞を殺す」のではなく、「がん細胞を正常細胞に戻す」ことでがんを治療します。
——そもそも、なぜがん細胞は無限に増殖してしまうのでしょうか?
阿保:細胞は2つの娘細胞に分裂するのですが、その過程を細胞周期と呼び、細胞周期はG1期→S期(DNAの複製)→G2期→M期(細胞分裂)→G1期…というDNAの複製と分裂の繰り返しで構成されます。通常、必要でない場合には細胞はG1期からG0期という静止期に入り、分裂を停止しますが、がん細胞はこの細胞周期を回り続け、無限に増殖します。
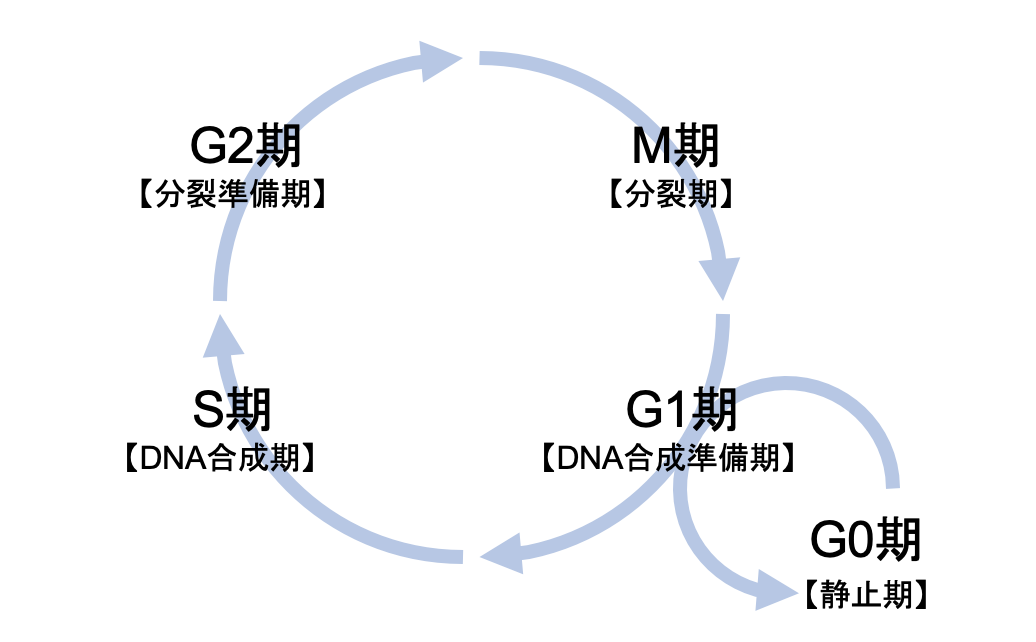
DNAは2本鎖でできていますが、その複製のためには、鋳型として1本鎖にほどかなければなりません。この、ほどく機能を持つタンパク質がDNAヘリカーゼです。そしてヘリカーゼが複製起点において活性を持つために必要なタンパクの一つがCDC6です。CDC6は細胞周期のG1期からS期への進行を司る「チェックポイント」を通るための「通行許可証」的な機能を持っています。
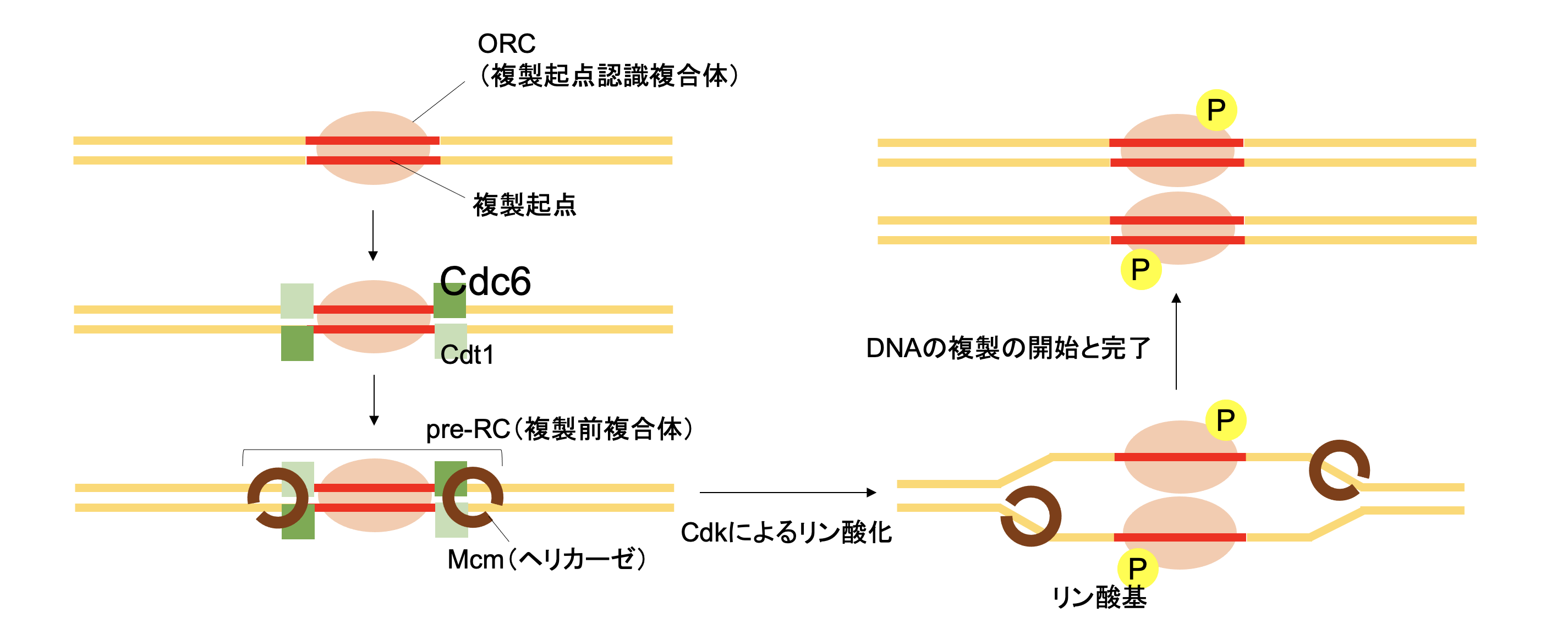
がん細胞が無限に増殖する原因の一つと考えられるのが、このCDC6タンパクです。CDC6は正常細胞ではG1期にのみ存在し、S期、G2期、M期には存在しませんが、がん細胞では細胞周期の全てのステージに豊富に存在しています。CDC6はS期、M期のステージ進行にも関わるようで、これががん細胞が「自己増殖シグナル」を出し続け、無限増殖する理由の一つと考えられています。
また、CDC6は過剰に発現することにより、INK4/ARFというがん抑制遺伝子の発現を抑制することもわかっています。「抑制」が「抑制」されるので、発がんが誘発されるリスクは相当に大きくなります。
——ということは、CDC6を減らす、もしくは無くしてやればよい、ということになりますか?
阿保:はい。その方法が、2006年にノーベル生理学・医学賞を受賞したRNA干渉(RNAi)という機構です。これは、タンパク質はDNAに転写されたmRNAが翻訳されて発現しますから、該当するタンパク質に対応するmRNAを潰してやれば、そのタンパク質が機能できなくなることを狙うものです。
shRNAというヘアピン型のRNAを細胞に送り込むことで、まずDicerによって1本鎖に分解されます。それがRISC(RNA誘導サイレンシング複合体)という複合体に組み込まれ、目的のmRNAと相補的に塩基対を形成し、分解へと至らしめます。
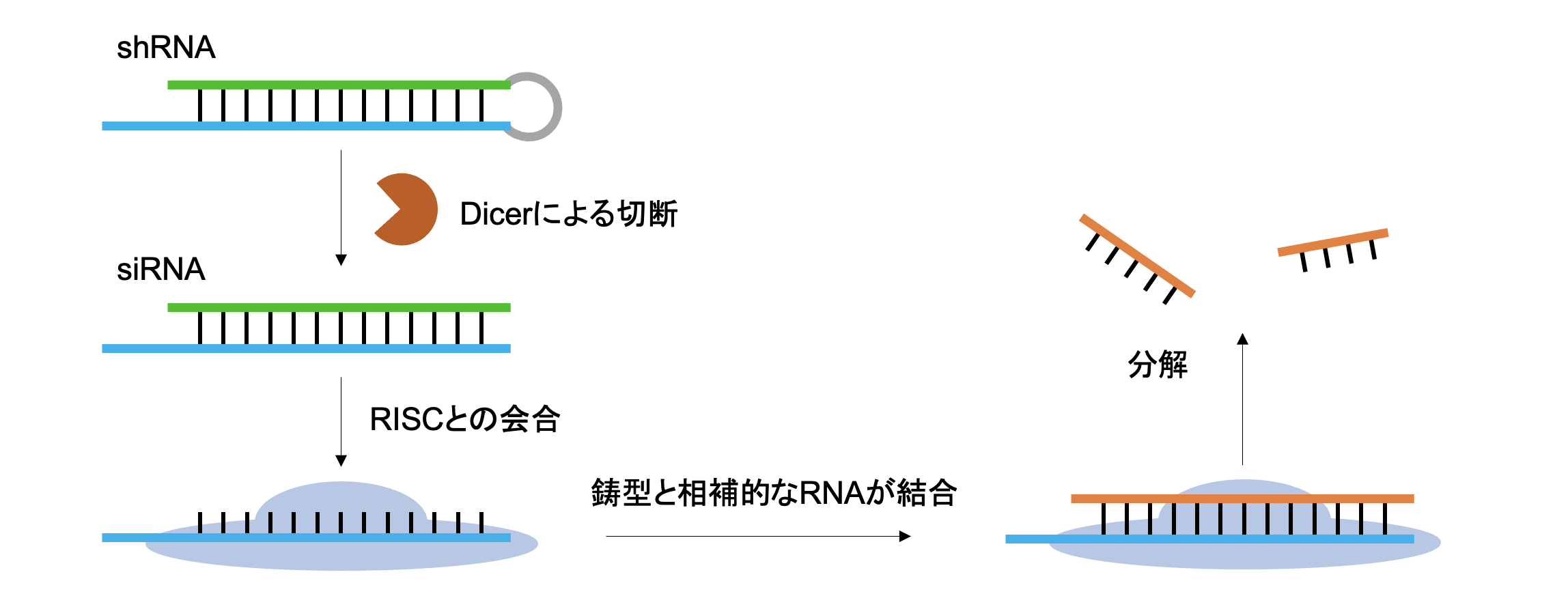
本療法ではCDC6に対応するshRNAを送り込み、CDC6の発現をノックダウンすることを狙っています。がん細胞では「チェックポイント」が破綻していることがありますが、CDC6という「通行許可証」がないのに「チェックポイント」を通過しようとする、専門的に言えば、DNA複製起点が標識されていないのに複製しようとすることで、複製不全が生じ、アポトーシスという細胞の自殺が誘導されます。
このようにして、細胞の増殖能を止めること、細胞死回避能力を打ち消すことを目指しています。
——どのような方法でshRNAを細胞に送り込むのでしょうか?
阿保:病原性を消したウイルスをベクター、すなわち「運び屋」として用いています。とりわけ、レンチウイルスというものを用いており、これは細胞への導入効率と安定性に優れたものになります。このベクターを点滴や局所注射によって細胞に送り込んでいます。
そして、このベクターにはCDC6 shRNAだけでなく、P16、P53、PTENといったがん抑制遺伝子も搭載されています。がん細胞の増殖停止・老化・自殺を誘導するだけでなく、がん抑制タンパクの活性化も狙っています。
——がんが嫌うものが合理的に送られているのですね。しかし、正常な細胞に送り届けられ、CDC6が打ち消されるということは問題にはならないのでしょうか。
阿保:確かに、正常細胞にベクターは届く可能性はあります。しかし、このベクターはがん細胞でのみ機能するように制御されています。
細胞の寿命を決めるのはDNA鎖の末端にあるテロメアという部分で、正常細胞であればDNA複製を繰り返すたびに短くなり、一定の長さより短くなると細胞分裂を停止します。しかしがん細胞ではhTERT(テロメラーゼ逆転写酵素)という酵素が機能し、テロメアを伸長することで不死化を実現しています。
本療法で用いるベクターにはhTERTプロモーターという、hTERTが機能する場合にのみshRNAなどが発現するような制御機構が備わっています。したがって、がん細胞に送達された時のみベクターが作用するようになっているのです。
——がんの特徴をあえて活用する戦略なのですね。ところで、RNAiのターゲットをCDC6としていますが、他の標的遺伝子をノックダウンすることで更なる効果増強は望めないのでしょうか?
阿保:CDC6は細胞周期を制御する遺伝子群の上流に位置しているため、これをターゲットとすることはある程度は合理的だと考えています。しかし、他にも有効なターゲットが存在する可能性があり、それを模索する動きもあります。その場合は動物実験を行い、エビデンスを積み上げ、効果を確かめる必要があるでしょう。
——今後の更なる発展が期待できそうですね。
お問い合わせ
次回の記事では、CDC6 RNAi療法の臨床的価値についてお伝えします。
北青山Dクリニック:https://www.dsurgery.com/









































![[がん治療の現状と課題]放射線治療の課題、秋元先生の取り組み #03](https://doctor-journal.com/wp-content/uploads/2024/02/06e0d7d2282c5b5f17ff718a92ca8b70-80x80.png)
![[がん治療の現状と課題]患者の懸念、医療制度の課題 #02](https://doctor-journal.com/wp-content/uploads/2024/01/f921745e9e011d0f14238fc3803310b9-80x80.png)

専門家のコメント
ドクタージャーナル東大生チーム・コーチ兼メンター 2023年09月13日
現役東大生プロジェクトへのご協力、ありがとうございました。
学生の質問に対し、丁寧かつ真摯にご対応されている阿保義久先生。
先生の暖かく誠実なお人柄にも、あらためて感動いたしました。